|
| 疾管署人體研究倫理審查會委員劉宏恩今天在臉書發文表示,台產疫苗的紛爭來自許多不公開、不透明的作業方式和標準,已對主管機關的公信力造成傷害。(劉宏恩臉書) |
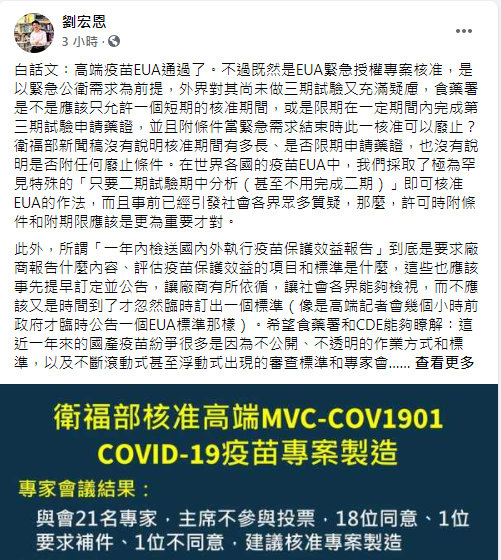
中評社台北7月19日電/台產高端疫苗通過EUA(緊急使用授權),“衛福部”也允許高端專案生產,台灣政治大學法律學系副教授、“衛福部”疾管署人體研究倫理審查會委員劉宏恩今天在臉書發文表示,外界對高端疫苗尚未做三期試驗充滿疑慮,EUA在許可時應附加條件和期限,也點出台產疫苗的紛爭來自許多不公開、不透明的作業方式和標準,已對主管機關的公信力造成傷害。
蔡英文6月在高端疫苗第二期人體試驗尚未解盲之前,即率先宣布預計7月底可以開始供應第一波台產疫苗。
劉宏恩臉書全文:
白話文︰高端疫苗EUA通過了。不過既然是EUA緊急授權專案核准,是以緊急公衛需求為前提,外界對其尚未做三期試驗又充滿疑慮,食藥署是不是應該只允許一個短期的核准期間,或是限期在一定期間內完成第三期試驗申請藥證,並且附條件當緊急需求結束時此一核准可以廢止?“衛福部”新聞稿沒有說明核准期間有多長、是否限期申請藥證,也沒有說明是否附任何廢止條件。
在世界各國的疫苗EUA中,我們採取了極為罕見特殊的“只要二期試驗期中分析(甚至不用完成二期)”即可核准EUA的作法,而且事前已經引發社會各界眾多質疑,那麼,許可時附條件和附期限應該是更為重要才對。
此外,所謂“一年內檢送國內外執行疫苗保護效益報告”到底是要求廠商報告什麼內容、評估疫苗保護效益的項目和標準是什麼,這些也應該事先提早訂定並公告,讓廠商有所依循,讓社會各界能夠檢視,而不應該又是時間到了才忽然臨時訂出一個標準(像是高端記者會幾個小時前政府才臨時公告一個EUA標準那樣)。
希望食藥署和CDE能夠瞭解︰這近一年來的“國產”疫苗紛爭很多是因為不公開、不透明的作業方式和標準,以及不斷滾動式甚至浮動式出現的審查標準和專家會議人選,還有失去分際的扶植宣傳,所造成的各種疑慮與公信力上的傷害。但願主管機關不要再重蹈覆轍,繼續施行自以為是協助“國內”產業卻實際上揠苗助長傷害生技產業的措施,能夠試著重建外界對於主管機關和審查者獨立客觀地位的信任。 |

